Trong bối cảnh đại dịch COVID-19 diễn biến phức tạp, cùng với nhiều quốc gia trên thế giới, Việt Nam đang trong cuộc chạy đua để nghiên cứu sản xuất và làm chủ nguồn cung cấp vắc xin phòng COVID-19. Đây được coi là giải pháp hiệu quả nhất để thực sự đẩy lùi dịch bệnh này.
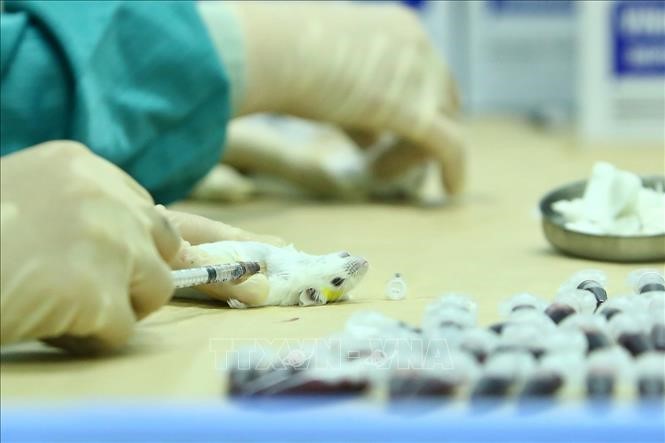 |
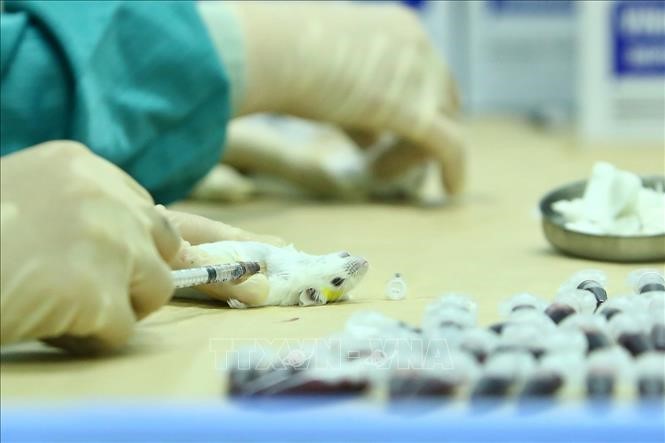
| Lấy mẫu huyết thanh của chuột đã tiêm dự tuyển vắc xin COVID-19, để đánh giá khả năng sinh miễn dịch vào ngày 15/5/2020 và 29/5/2020. Ảnh: Minh Quyết/TTXVN |
Trong bối cảnh đại dịch COVID-19 diễn biến phức tạp, cùng với nhiều quốc gia trên thế giới, Việt Nam đang trong cuộc chạy đua để nghiên cứu sản xuất và làm chủ nguồn cung cấp vắc xin phòng COVID-19. Đây được coi là giải pháp hiệu quả nhất để thực sự đẩy lùi dịch bệnh này.
Tuy nhiên, làm thế nào để vắc xin có thể đưa vào sử dụng trong thời gian sớm nhất mà vẫn đảm bảo tính hiệu quả và an toàn là bài toán đặt ra đối với các nhà khoa học cũng như cơ quan quản lý nhà nước, trong trường hợp khẩn cấp.
Chủ động công nghệ nghiên cứu sản xuất vắc xin
Hiện Việt Nam có 4 đơn vị tham gia nghiên cứu sản xuất vắc xin gồm: Công ty trách nhiệm hữu hạn một thành viên Vắc xin và Sinh phẩm số 1 (VABIOTECH); Trung tâm Nghiên cứu Sản xuất Vắc xin và Sinh phẩm Y tế (POLYVAC);
Viện Vắc xin và Sinh phẩm y tế (IVAC) và Công ty trách nhiệm hữu hạn Dược Nanogen. Trong đó, tới thời điểm này, có 3 nhà sản xuất đang làm nghiên cứu tiền lâm sàng là VABIOTECH, POLYVAC và Nanogen.
Theo đánh giá của giới chuyên môn, vắc xin COVID-19 của nhà sản xuất IVAC đang đảm bảo về mặt thời gian và tính khả thi nhất. Tiến sĩ Dương Hữu Thái, Viện trưởng Viện Vắc xin và Sinh phẩm y tế (IVAC) cho biết: Để nghiên cứu sản xuất vắc xin COVID-19, IVAC sử dụng chủng NDV-LaSota-S làm vector biểu hiện protein S của SARS-CoV-2.
Đây là chủng có độc lực thấp được sử dụng trong nhiều loại vắc xin. Chủng virus này được đánh giá thích ứng và phát triển tốt trên trứng gà có phôi. Dự án này được hợp tác giữa Đại học Icahn (Mỹ) và ba nhà sản xuất vắc xin có cùng công nghệ là GPO (Thái Lan), Butantan (Brazil) và IVAC.
Mục tiêu của IVAC là sản xuất được vắc xin COVID-19 số lượng lớn với giá thành hợp lý, có thể sử dụng được nhà máy sản xuất vắc xin cúm đại dịch hiện có của mình.
Tiến sĩ Dương Hữu Thái chia sẻ: IVAC đã sản xuất thử thành công ba lô trên dây chuyền hiện có, kết quả ban đầu cho thấy, chất lượng sản phẩm đạt yêu cầu. Ngày 20/7 vừa qua, Viện đã gửi mẫu sang Mỹ để đánh giá độc tính trên động vật thí nghiệm.
Trong tháng 8, Viện sẽ thẩm định, tối ưu hóa quy trình sản xuất và từ tháng 10 - tháng 12 sẽ thử nghiệm trên người giai đoạn 1. Hai giai đoạn thử nghiệm lâm sàng tiếp theo sẽ tiến hành vào đầu năm 2021.
Dự kiến, quý IV năm 2021, IVAC sẽ nộp hồ sơ cấp phép sản phẩm. Nếu đúng như dự đoán, tháng 10/2021, Việt Nam sẽ có vắc xin ngừa COVID-19.
Bên cạnh nghiên cứu này, dự án nghiên cứu phát triển vắc xin COVID-19 của VABIOTECH cũng đang có triển vọng rất tích cực, khi vượt tiến độ 2 tháng so với kế hoạch trong giai đoạn 1.
Kết quả đáp ứng miễn dịch khá cao trên chuột được tiêm thí nghiệm, sau khi đánh giá tại Viện Vệ sinh dịch tễ Trung ương. Dự kiến, đầu năm 2021, vắc xin của VABIOTECH có thể đưa vào tiêm thử nghiệm trên người.
Ông Đỗ Tuấn Đạt, Chủ tịch VABIOTECH cho biết: Để cho ra đời vắcxin hoàn chỉnh cần 9-12 tháng nữa, nhưng chúng tôi đang nỗ lực để rút ngắn thời gian này.
Công nghệ mà VABIOTECH sử dụng trong sản xuất vắc xin phòng COVID-19 lần này là công nghệ vector virus, thay vì công nghệ vắc xin bất hoạt hay vắcxin sống giảm độc lực như truyền thống.
Đây là công nghệ mới, đa năng, cho hiệu suất sản xuất cao, không phụ thuộc vào việc nuôi cấy toàn thể tác nhân gây bệnh, phù hợp đối với các vắc xin đại dịch.
Giáo sư Đặng Đức Anh, Viện trưởng Viện Vệ sinh dịch tễ Trung ương chia sẻ: Trung Quốc và nhiều nước khác đang thử nghiệm vắc xin ngừa COVID-19 trên người hoặc tiến hành thử nghiệm song song trên động vật và trên người.
Với vắc xin của Việt Nam, hiện mới đang ở bước đầu thử nghiệm trên động vật. Như vậy, so với các nước, Việt Nam đang đi chậm hơn một chút.
Tuy nhiên, chúng ta có thể chứng kiến các nhà sản xuất vắc xin khác thử nghiệm nhằm đảm bảo kết quả chắc chắn hơn, do đây là một dịch bệnh mới, virus mới, vắc xin mới.
Để có được những kết quả nghiên cứu như hiện nay không phải đơn giản, khi thông thường theo cách làm cũ, chúng ta mất đến 5-10 năm mới có thể cho ra đời một vắc xin mới.
Theo các nhà khoa học Việt Nam, dự án lần này không chỉ dừng lại ở việc cho ra đời loại vắc xin cả thế giới chờ đợi mà mục tiêu lớn hơn là giúp tăng tính chủ động về vắc xin cho Việt Nam, nhất là các vắc xin đại dịch.
Bởi trong tương lai, nếu xuất hiện chủng virus Corona gây đại dịch ở người, với công nghệ có sẵn trong tay, chúng ta chỉ cần "lắp ráp" phần gen của virus mới vào là sẽ cho ra đời vắc xin mới rất nhanh, sẵn sàng và chủ động có vắc xin phòng bệnh.
Rút ngắn quy trình cấp phép
Tiến sĩ Kidong Park, Trưởng Đại diện Tổ chức Y tế thế giới (WHO) tại Việt Nam chia sẻ: Thế giới cần vắc xin chất lượng cao càng sớm càng tốt và chúng tôi hoan nghênh sự tham gia của Việt Nam vào nỗ lực chung toàn cầu nhằm nghiên cứu và phát triển vắc xin COVID-19.
WHO là cơ quan điều phối cơ chế tăng tốc tiếp cận các công cụ COVID-19 - một sáng kiến hợp tác toàn cầu nhằm thúc đẩy phát triển, sản xuất và đảm bảo sự bình đẳng trong việc tiếp cận xét nghiệm, liệu pháp điều trị và vắc xin COVID-19.
Trong đó, hợp phần vắc xin được gọi là COVAX, WHO hợp tác với CEPO và Gavi nhằm tối đa hoá quá trình phát triển vắc xin cũng như việc tiếp cận và phân bổ công bằng vắc xin cho các quốc gia. Nhiều quốc gia, trong đó có Việt Nam đã được mời tham gia cơ chế COVAX.
Theo sáng kiến này, các nước thu nhập cao và các nước thu nhập trung bình cao sẽ tiếp cận được vắc xin thông qua mua sắm tập trung dùng nguồn tài chính viện trợ.
Gavi sẽ hỗ trợ tài chính giúp các nước thu nhập trung bình thấp và các nước thu nhập thấp để mua vắc xin. Do vậy, nếu tham gia cơ chế COVAX, Việt Nam sẽ tăng cường khả năng tiếp cận với nguồn vắc xin COVID-19 cũng như các nguồn tài trợ khác.
Tại hội thảo mới đây về việc triển khai nghiên cứu sản xuất, thử nghiệm lâm sàng, cấp phép đăng ký, sử dụng vắc xin COVID-19 tại Việt Nam, các chuyên gia trong nước và quốc tế đã kiến nghị với Bộ Y tế, các cơ quan quản lý và các Hội đồng Đạo đức để đẩy nhanh lộ trình sản xuất vắc xin COVID-19 tại Việt Nam.
Ông Nguyễn Ngô Quang, Phó Cục trưởng Cục Khoa học công nghệ và Đào tạo (Bộ Y tế) cho biết: Trên cơ sở hướng dẫn trong trường hợp khẩn cấp của các quốc gia, đặc biệt của Hoa Kỳ và cộng đồng chung châu Âu, hiện Bộ Y tế đang hoàn thiện Hướng dẫn, quy trình để xem xét thẩm định, phê duyệt về quá trình thử nghiệm lâm sàng, kiểm định, cấp phép lưu hành văc xin COVID-19 trong trường hợp khẩn cấp.
Theo đó, rút ngắn hồ sơ, thủ tục hành chính nghiên cứu và sản xuất vắc xin COVID-19 xuống còn khoảng 1 năm, thay vì từ 3- 5 năm đối với một nghiên cứu thử nghiệm lâm sàng vắc xin hiện nay, nhằm phục vụ tính khẩn cấp khi đại dịch COVID-19 vẫn đang diễn biến bất thường.
Tuy nhiên, dù rút ngắn thời gian nhưng vẫn phải đảm bảo chất lượng của vắc xin, có tác dụng phòng nhiễm virus COVID-19 dựa trên những bằng chứng khoa học, tuân thủ theo các nguyên tắc về đạo đức trong nghiên cứu y sinh học.
Cụ thể, Bộ Y tế sẽ rút ngắn thời gian xem xét thẩm định vắc xin COVID-19. Trước đây, quá trình này dự kiến thực hiện trong 60 ngày (2 tháng) thì với vắc xin COVID-19 sẽ rút xuống còn 12 ngày. Cơ quan quản lý cũng như Hội đồng chỉ đạo quốc gia sẽ xem xét thẩm định tối đa trong vòng 10 ngày.
Đối với quy trình nghiên cứu, trước đây, căn cứ trên đề cương, các đơn vị phải hoàn thiện giai đoạn trước mới được thực hiện giai đoạn sau.
Quy trình này sẽ kéo dài trong 3-5 năm cho một nghiên cứu thử nghiệm lâm sàng vắc xin thì hiện nay theo chỉ đạo của Quyền Bộ trưởng Bộ Y tế, Hội đồng sẽ xem xét thẩm định “gối đầu”, nghĩa là giai đoạn 1 theo quy định thực hiện trong thời gian 3 tháng.
Tuy nhiên, sau khoảng 1,5 tháng, cơ quan quản lý đã có thể thẩm định và nếu nghiên cứu bảo đảm an toàn thì cho phép đơn vị chuyển sang ngay giai đoạn 2, đồng thời tiếp tục theo dõi giai đoạn 1.
Giai đoạn 2 cũng tương tự như vậy, nếu thực hiện trong 9 tháng thì khoảng 4,5 tháng, cơ quan quản lý cũng đã có thể thẩm định, nếu bảo đảm an toàn, có dữ liệu về tính sinh miễn dịch, thì cho phép chuyển sang giai đoạn 3 và tiếp tục xem xét giai đoạn 2.
Về nguyên tắc, giai đoạn 3 là giai đoạn thử nghiệm lâm sàng kéo dài 12 tháng, nhưng sau 6 tháng, nếu đã có những dữ liệu liên quan đến an toàn tính sinh miễn dịch và tính bảo vệ thì có thể xem xét ngay hồ sơ để cấp phép, đồng thời tiếp tục theo dõi thời gian 6 tháng thử nghiệm còn lại.
Đây là những giải pháp phục vụ cho tình trạng khẩn cấp. Các quốc gia Châu Âu hay Mỹ cũng thực hiện như vậy. Bộ Y tế Việt Nam cũng sẽ xây dựng hướng dẫn tương tự.
Với phương pháp này, chúng ta vẫn bảo đảm về tính khoa học, tính đạo đức, đồng thời rút ngắn được thời gian xem xét, nghiên cứu vắc xin COVID-19.
Bên cạnh đó, vai trò của cơ quan quản lý và Hội đồng đạo đức sẽ luôn phải theo dõi giám sát trong suốt quá trình triển khai nghiên cứu vắc xin, để đảm bảo tính an toàn và dữ liệu khoa học.
Hiện, Cục Khoa học công nghệ và Đào tạo đã làm việc với Vụ Pháp chế, Viện Kiểm định vắc xin, Cục Quản lý Dược… để cùng phối hợp trong suốt quá trình nghiên cứu vắc xin COVID-19, không chờ kết quả rồi mới kiểm định hoặc có kết quả mới thẩm định hồ sơ.
Trong suốt quá trình triển khai, các vụ, cục sẽ tham gia vào quá trình nghiên cứu để rút ngắn thời gian xem xét thẩm định hồ sơ, cũng như kiểm định chất lượng vắc xin nhằm đảm bảo đúng tiến độ.
Sớm nhất, ngay trong tuần tới, Bộ Y tế sẽ ban hành hướng dẫn này để các đơn vị nghiên cứu sản xuất và thử nghiệm lâm sàng vắc xin COVID-19 trên cả nước thực hiện.
Theo Việt Hà (TTXVN)













Thông tin bạn đọc
Đóng Lưu thông tin